Phản ứng nhiệt nhôm tổng quát
Al + oxit kim loại → oxit nhôm + kim loại
(hỗn hợp X) (hỗn hợp Y)
2yAl + 3MxOy →t0 yAl2O3 + 3xM (M là các kim loại trung bình như Fe, Cu, Cr,…)
Phản ứng xảy ra không hoàn toàn
Ví dụ: 2Al + Fe2O3 →t0 Al2O3 + 3Fe
=> hỗn hợp Y gồm Al2O3, Fe, Al dư và Fe2O3 dư
– Tính H phản ứng nhiệt nhôm, tính theo chất có tỉ lệ nhỏ hơn (đnAlbđnFe2O3)
– Bảo toàn khối lượng: mhhX = mhhY
– Bảo toàn nguyên tố:
– Bảo toàn electron:
+ Cho Al dư tác dụng với dung dịch NaOH sinh ra H2: 3.nAl dư = 2.nH2
+ Hỗn hợp sau phản ứng (Al dư, Fe, oxit ) tác dụng với H+ : 3.nAl dư + 2.nFe = 2.nH2
+ Hh sau phản ứng gồm kim loại và oxit kim loại
2H+ + O2- → H2O
2H+ + 2e → H2
=> nH+ pứ
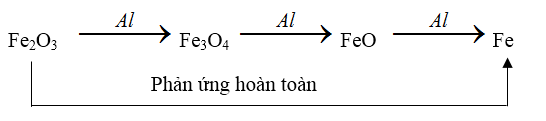
+ Với oxit của kim loại hóa trị nhiều hóa trị : quá trình nhiệt nhôm xảy ra theo từng nấc

 Cộng đồng hỏi đáp làm giàu
Cộng đồng hỏi đáp làm giàu